AGAO
(Anthrobacter globiformis amine oxidase)
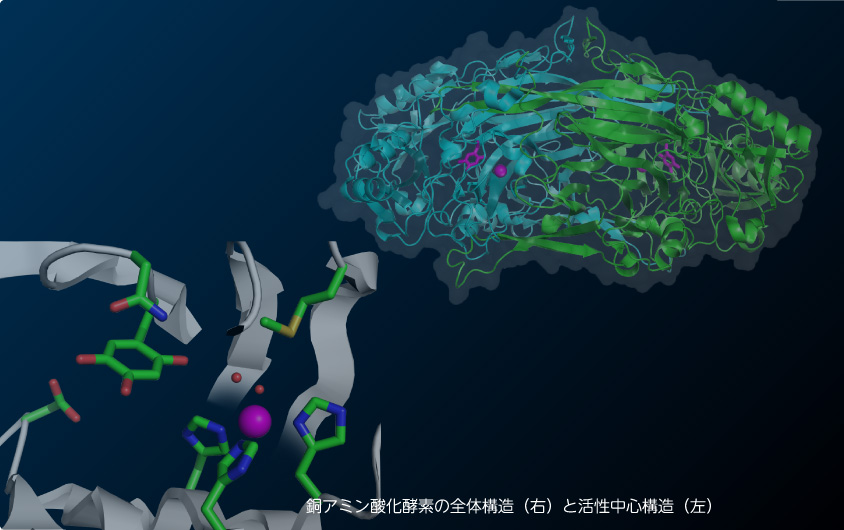
アミン酸化酵素は様々な生物種に普遍的に存在し、各種の一級アミンの酸化的脱アミノ反応を触媒する。本酵素は、微生物においては、アミン類を資化するために機能するが、高等生物ではヒスタミンなどの生理活性アミンの消去系として機能するばかりでなく、シグナル伝達系へ関与するなど多彩な生理機能をもつ。様々な基質特異性をもつ銅アミン酸化酵素が同定されているが、活性中心には酸化還元補酵素トパキノン(TPQ)と銅イオンが存在し、共通した反応機構を有していることを示唆している。本酵素のユニークな点として、補酵素TPQは特定のチロシン残基から、酵素の自己触媒的な酸化反応によって作り出されていることがある。すなわち、銅アミン酸化酵素は単一回転の補酵素形成反応と多回転の触媒反応の二機能性酵素であり、二つの解析すべき反応機構があるといえる。我々は、土壌細菌Arthrobacter globiformisに由来した銅アミン酸化酵素(AGAO)(1-4)を用いて、両反応に対して、反応速度論的な解析と反応中間体の結晶構造解析を組み合わせ、詳細な分子機構を明らかにすることを目指している。様々な条件で、前駆体AGAO結晶を銅イオンでソーキングしたり、活性型酵素結晶を基質アミンでソーキングすることよって、結晶内に各種の反応中間状態を作り出すことが可能である。そのため、極めて詳細な機能・構造解析が可能である。これまでに、補酵素形成反応中間体や基質アミンと形成される触媒反応中間体の詳細、プロトンの移動機構などを解明し、さらに、補酵素が2つのコンフォメーションを切り替て、効率的な反応が達成されていることを明らかにしている。
関連文献
- Kim M, Okajima T, Kishishita S, Yoshimura M, Kawamori A, Tanizawa K, Yamaguchi H.
X-ray snapshots of quinone cofactor biogenesis in bacterial copper amine oxidase.
Nature Struct. Biol., 9, 591-596 (2002) [PubMed] - Kishishita S, Okajima T, Kim M, Yamaguchi H, Hirota S, Suzuki S, Kuroda S, Tanizawa K, Mure
M.
Role of copper ion in bacterial copper amine oxidase: Spectroscopic and crystallographic studies of metal-substituted enzymes.
J. Am. Chem. Soc., 125, 1041-1055 (2003) [PubMed] - Moore RH, Spies MA, Culpepper MB, Murakawa T, Hirota S, Okajima T, Tanizawa K, Mure M.
Trapping of a dopaquinone intermediate in the TPQ cofactor biogenesis in a copper-containing amine oxidase from Arthrobacter globiformis.
J. Am. Chem. Soc., 129, 11524-1134 (2007) [PubMed] - Murakawa T, Hamaguchi A, Nakanishi S, Kataoka M, Nakai T, Kawano Y, Yamaguchi H, Hayashi H,
Tanizawa K, Okajima T.
Probing the catalytic mechanism of copper amine oxidase from Arthrobacter globiformis with halide ions.
J. Biol. Chem., 290, 23094-23109 (2015) [PubMed]