[ 長時間、高速超解像イメージングを可能にする光スイッチング蛍光タンパク質Kohinoor2.0の開発 ]
( Tetsuichi Wazawa, Ryohei Noma, Shusaku Uto, Kazunori Sugiura, Takashi Washio, Takeharu Nagai, Microscopy, 70, 340–352, 2021 )
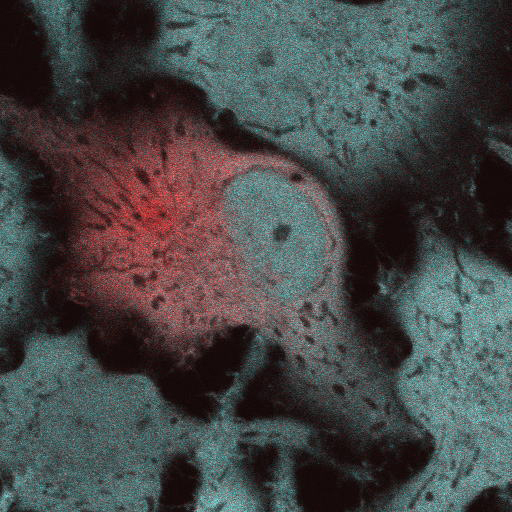
以前開発されたポジティブ型光スイッチング蛍光タンパク質Kohinoor ( Dhemendra K Tiwari et al., Nature Methods, 12, 2015 ) に遺伝子変異を導入することで、2.6倍高い蛍光強度と2.5倍早い発色団形成速度、1.5倍速いOFFスイッチング速度を示すKohinoor2.0の開発に成功しました。pH滴定から、Kohinoor2.0の発色団が少なくとも3状態をとることが判明し、平衡状態の変化からKohinoor2.0がKohinoorと比べて高輝度を示すことが判明しました。発色団の平衡状態のバランスが輝度向上に寄与することを示した例は今回が初めてで、蛍光タンパク質改良の新たなメカニズムとなることが期待されます。 また、Kohinoor2.0を用いて生きたCOS7細胞の超解像イメージングSPoD-OnSPAN ( Tetsuichi Wazawa, Microscopy, 67, 2018 ) 観察を行ったところ、4時間にわたるアクチンフィラメントの動態の可視化に成功しました。さらに、0.5秒の時間分解能でミトコンドリアの超解像イメージングを行い、従来の蛍光顕微鏡では捉えられなかったミトコンドリアの融合、分裂の高解像観察に成功しました。以上の研究から、Kohinoor2.0による、細胞小器官や分子の微細な動態のさらなる解明、さらにはカルシウムイオンなどの機能小分子動態の高解像観察の実現が期待されます。


[ 耐酸性・単量体型緑色蛍光タンパク質Gamillusの開発 ]
( Hajime Shinoda, Cell Chem Biol., 25, 3, 2018 )
ハナガサクラゲの光る触手から、蛍光タンパク質をコードする遺伝子を新規に同定し、タンパク質工学を用いて遺伝子改良することで、耐酸性で単量体型、高輝度の緑色蛍光タンパク質Gamillus ( Green fluorescent protein with acid-tolerance and monomeric property for illuminating soured environment の略 )を開発しました。一般によく使われる、緑色蛍光タンパク質EGFP( オワンクラゲ由来 )がpH6.0以下の酸性環境で蛍光を失うのに対して、Gamillusは酸性環境でも安定した蛍光を放ち、細胞内のほぼ全てのpH環境で使用可能です。Gamillusの立体構造をX線結晶解析法で決定したところ、一般的なGFPとは異なるトランス型の蛍光発色団を形成し、この構造が耐酸性メカニズムに寄与することを見いだしました。 酸性小器官は、2016年のノーベル医学・生理学賞受賞者の大隅良典博士が発見したオートファジーなど、多くの生命機能に密接に関わっています。しかし、既存の緑色蛍光タンパク質は、低pHで蛍光しないため、酸性小器官内での使用が限られていました。Gamillusを用いることにより、マクロオートファジーにより蛍光タンパク質が細胞質から酸性小器官のリソソーム輸送される過程を観察することが可能になりました。将来的には、既存の耐酸性の青色・赤色蛍光タンパク質と組み合わせることで、複数種のタンパク質を別々の色で標識して、同時に追跡することが可能となります。Gamillusは、酸性環境中の未知の生命現象を発見するための基盤技術となり、医学・創薬研究にも大きく貢献すると期待されます。
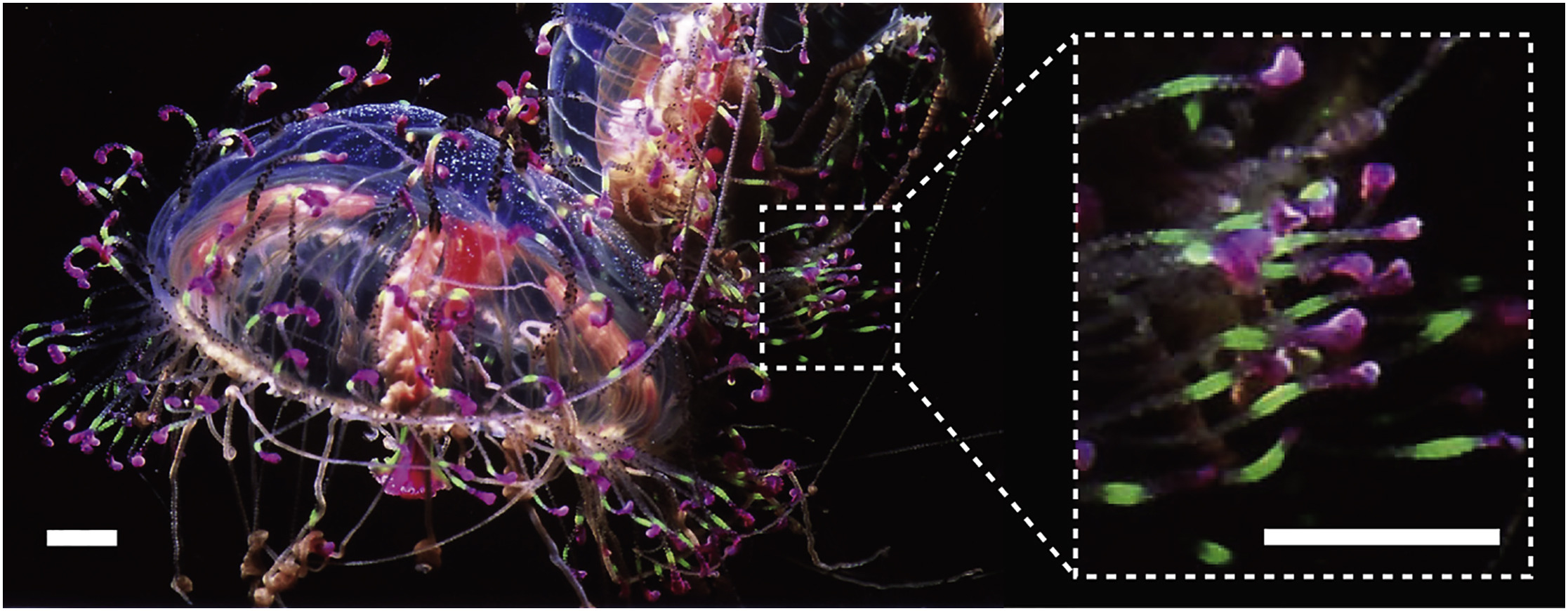
Gamillus作成の概略図。ハナガサクラゲの触手より、蛍光タンパク質の遺伝子をクローニングし、タンパク質工学により明るさや単量体度を改良した。
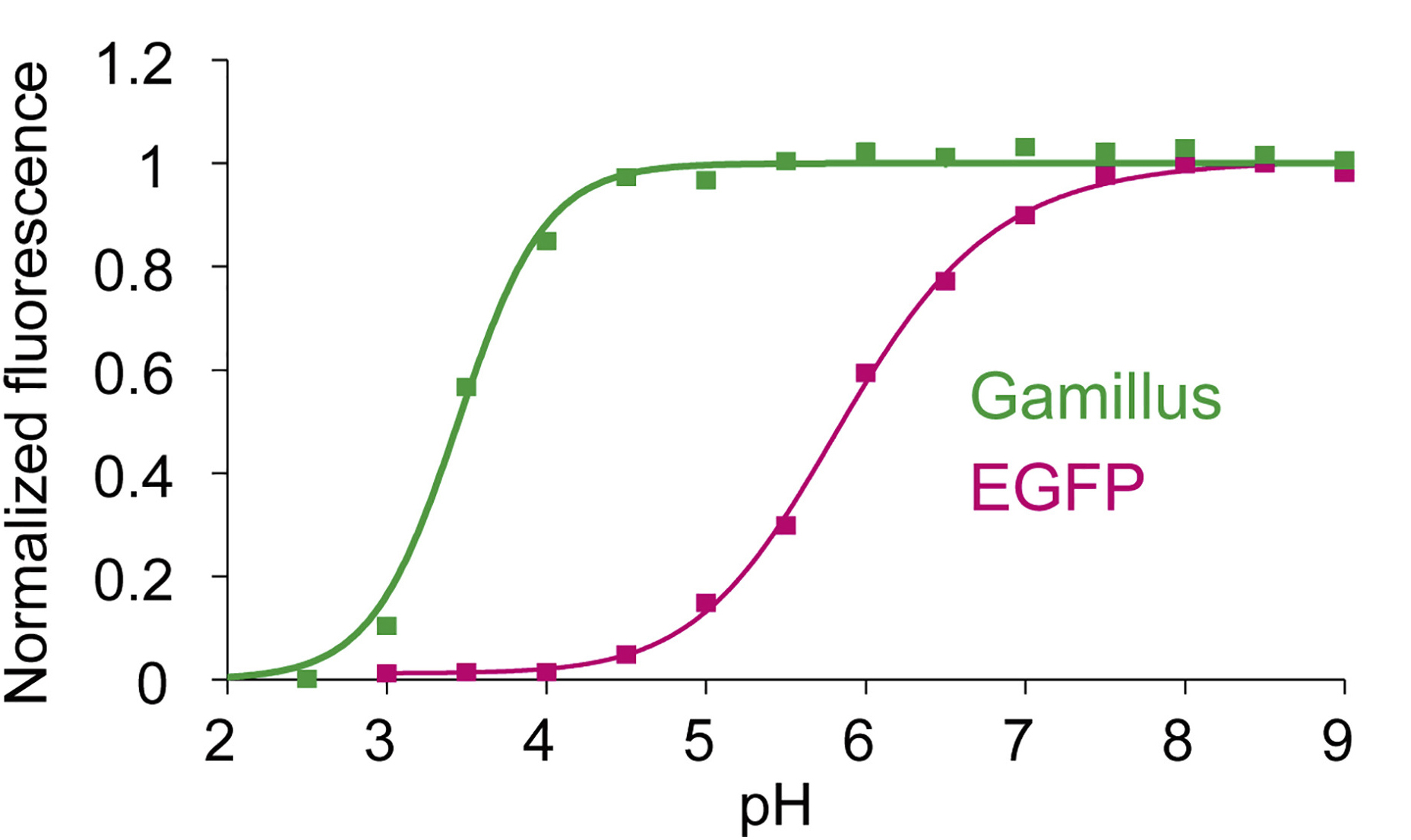
pHと蛍光タンパク質の蛍光強度の相関図。
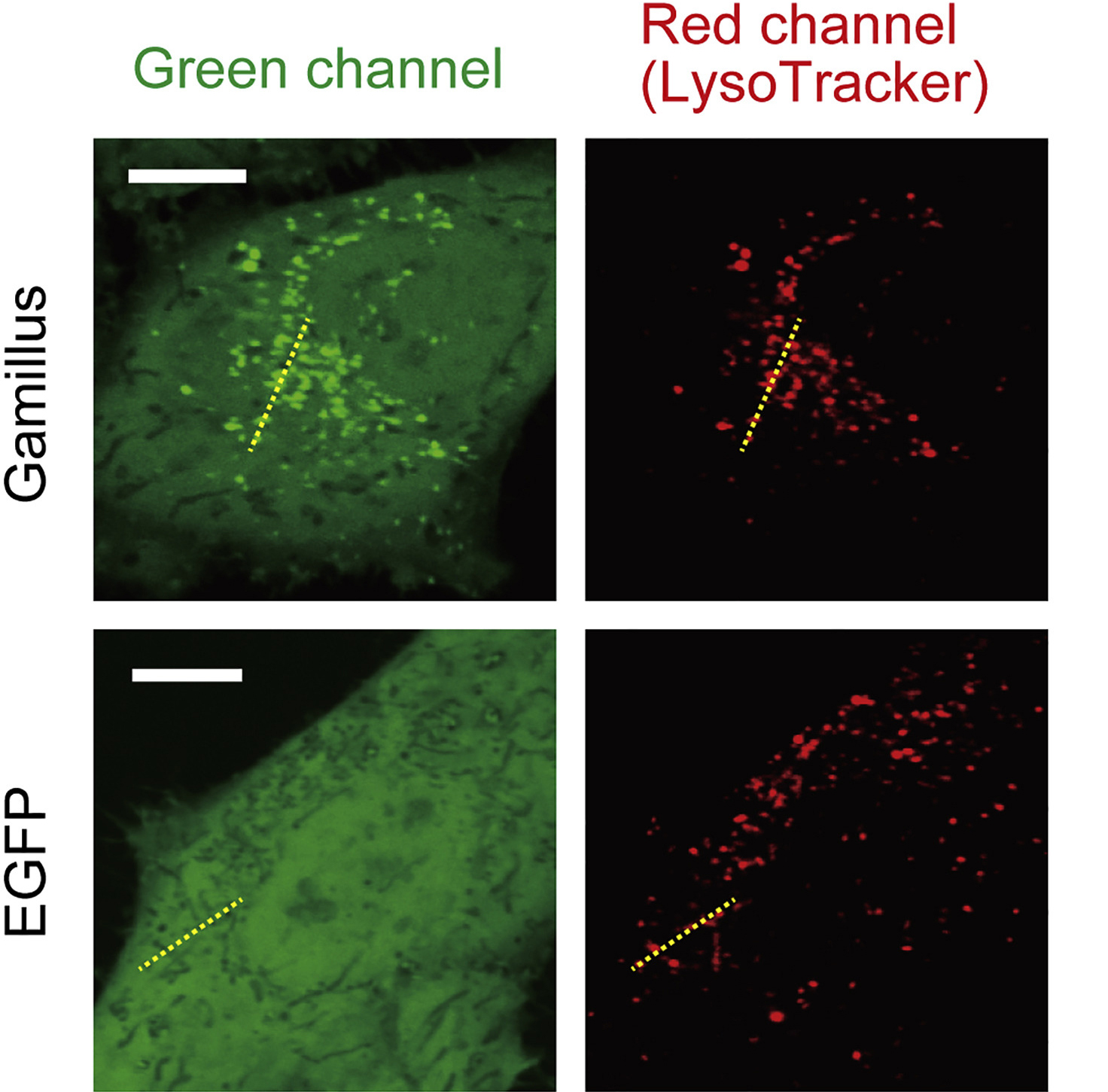
GamillusまたはEGFPを発現するHeLa細胞の蛍光画像。Gamillusを用いることで、マクロオートファジーによりタンパク質がリソソームへと輸送される過程を、蛍光で観察できるようになった。スケールバー:10 µm.
[ Kohinoor: A fast-positive switching, reversibly photoswitchable fluorescent protein ]
( Dhermendra K Tiwari, Nature Methods, 12, 2015 ) [ PDF ]
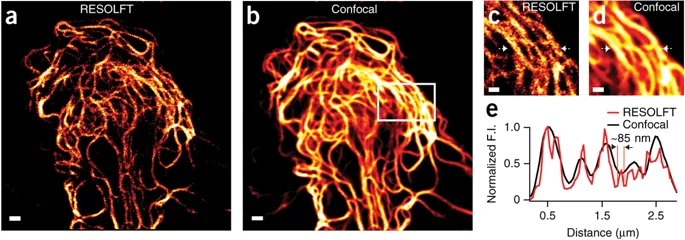
Light based nanoscopy become key tool to visualize biological structures at sub-nanometer scale, which is not possible by conventional microscopy. Chemistry Noble prize in 2014 for this technique has undoubtly proven high significance in life science research. Most of the nanoscopic methods depend on special photoswitchable fluorescent proteins ( PSFP ), those can be switch-on and off with light. However, the applications of currently available PSFPs are limited in live cell imaging due to photodamage induced by intense light exposure. Our research group developed a reversibly photoswitchable FP ( RSFP ); Kohinoor, with fast positive-photoswitching, high photostability and superior brightness. Kohinoor could be switch-on, switch-off and excited with 488 nm, 405 nm and 488 nm laser, respectively. Kohinoor has fastest switching speed and the highest photostability, which produce ~25 times more switching on-off cycles than the previous positive switching RSFP, Padron. The quantum yield ( QY ) of Kohinoor is 0.71, which is highest among all RSFPs. Kohinoor perfectly expressed to keep many switched on/off repeats with several fusion proteins in various types of cells: HeLa, HEK293, COS7, PC12 and E. coli cells. Thus, Kohinoor is well-suited as a fusion tag for various biological imaging purposes. In reversible saturable optical fluorescence transition ( RESOLFT ) nanoscopy, Kohinoor obtain super-resolved images of vimentin ( ~85 nm ) using a simpler optical setup and much lower laser power than has previously been possible. Therefor Kohinoor has potential in long time live cell nanoscopic imaging to explore cellular dynamics.
[ 蛍光タンパク質性の“ナノ爆弾”SuperNovaの開発 ]
( Kiwamu Takemoto, Scientific Reports, 3, 2629, 2013 )
蛍光タンパク質は、タンパク質や細胞を蛍光標識するためのツールとして生命科学研 究で大いに利用されています。一方、励起光照射により僅かながら発生する活性酸素に よって周囲の分子を酸化して不活性化する“ナノ爆弾”としての利用も原理的には可能であると考えられています。しかしながら、一般的な蛍光タンパク質は光照射による活性酸素の産生量が少なく、またKillerRed と呼ばれる活性酸素の産生能が高い蛍光タンパク質は2 量体を形成するため、他のタンパク質との融合に難がありました。
そこで今回我々はKillerRed をタンパク質進化工学により改変し、単量体型で効率よく活性酸素を産生する新しい蛍光タンパク質SuperNova を開発しました。さらに、SuperNova を用いて特異的なタンパク質の不活性化やアポトーシスの誘導などに成功しました。今後、多種多様なタンパク質や細胞の時空間的な機能の解析が可能な光遺伝学( オプトジェネティクス )用のツールになるばかりでなく、癌の光線力学療法などへの応用などが期待されます。
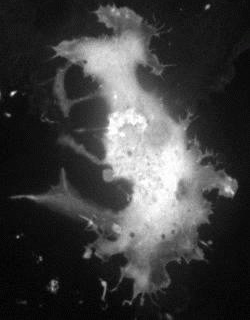
[ 生体組織内の任意の細胞での機能イメージングを可能にする光活性化型カルシウムイオンセンサー ( PA-TNXL )の開発 ]
( Tomoki Matsuda, Scientific Reports , 3, 1398, 2013 )
蛍光タンパク質を用いたライブイメージング技術の進歩により生命システムを理解するための研究手法は構成要素の網羅的解析から発展を遂げて、それぞれの構成要素が時空間的にどのように活性化/不活性化、或いは他の構成要素と相互作用するのかといった動的な観点での解析を行うための手法の開発が求められています。例えば、発生過程の個体内の特異的領域の生理機能を可視化する場合、組織特異的遺伝子プロモーターを用いて機能センサータンパク質を観察したい部位に発現させることが要求されるのですが、現在利用可能な遺伝子プロモーターで発現部位の任意性を保障する事は不可能です。従って、機能センサータンパク質を任意の領域に“出現”させる新たな技術として、光刺激によって活性化できるセンサータンパク質の開発が望まれていました。
そこで、我々は蛍光タンパク質間のFRETを利用したCa2+センサータンパク質TN-XLを基に、そのFRETドナー分子とアクセプター分子をそれぞれ光活性化蛍光タンパク質と無蛍光性色素タンパク質に置換することにより光活性化Ca2+ センサー PA-TNXLを開発しました。PA-TNXLをHeLa細胞に発現させ、405nmのレーザー照射により任意の細胞を蛍光化して、ヒスタミン刺激を与えた時に生じるCa2+濃度の振動を蛍光強度変化として可視化することができました。更に、PA-TNXLを発現させたラット海馬神経細胞のdissociation cultureの任意の細胞を光刺激によって蛍光化し、自発的な神経発火に伴うCa2+濃度変化をイメージングすることに成功しました。本センサーは、組織特異的イメージングに有用であると共に、神経細胞のような複雑に入り組んだ細胞集団内での任意の1細胞のCa2+イメージングを可能にし、発生・神経生物学研究のツールの1つとして研究に貢献することが期待されます。
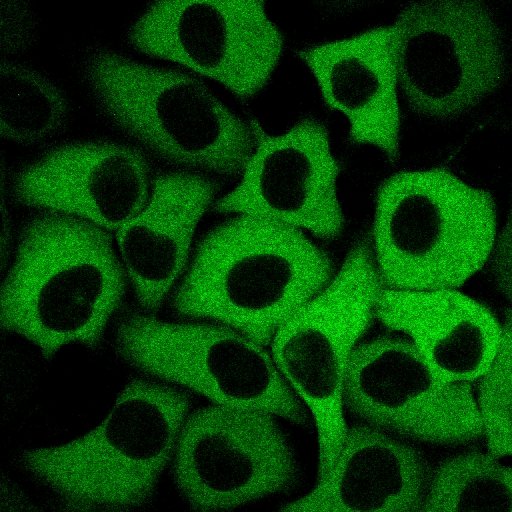
[ より多彩にカルシウムイオンを検出できる、DNAにコードされた青、緑、赤色のカルシウムイオン指示薬の開発 ]
( Yongxin Zhao, Science, 333: 1888-1891, 2011 )
下村脩博士らのノーベル賞受賞で知られる緑色蛍光タンパク質「GFP」に代表される蛍光タンパク質は、細胞や生体分子を蛍光標識することを主用途として、現在では医学・生物学研究に広く用いられるようになりました。
近年では、GFPを遺伝子光学的に改変することにより、細胞内の酸素の活性化やイオンの濃度変化などを計測することができる指示薬も開発されています。しかし、従来のCa2+指示薬は計測波長域が青緑色から緑色域に限定されていたり、Ca2+結合によって起きる蛍光強度の変化が小さいためにわずかなCa2+濃度の変化をとらえることができないという短所がありました。
そこで今回の研究では、GFPの円順列変異体を利用した緑色蛍光Ca2+指示薬である「GCaMP3」の遺伝子に「エラー誘発PCR法」と遺伝子シャッフリング法を用いてランダムに遺伝子変異を導入し、2600%ものシグナル変化率を有する緑色指示薬「G-GECO」( ジーゲッコー: green fluorescent genetically-encoded Ca2+indicators for optical imaging )の開発に成功しました。さらに、そのG-GECOの蛍光団を構成するアミノ酸の一種である「チロシン」を「ヒスチジン」に置換することで、青色指示薬「B-GECO」を、また、赤色蛍光タンパク質「mApple」をもとにした赤色指示薬「R-GECO」の開発にも成功しました。 次いで、B-GECO、G-GECO、flash-pericamの遺伝子混合物を鋳型にして「エラー誘発PCR法」を行った結果、Ca2+の結合によって蛍光色が緑から青色に変化する「GEM-GECCO」の開発にも成功しました。GEM-GECOはCa2+の結合により、蛍光シグナル( 青の蛍光強度/緑の蛍光強度 )が11,000%も変化し、これまでのどの指示薬よりもズバ抜けて大きな、変化量を示します。そのほか、励起2波長計測型「GEX-GECO」も開発しました。 これらGECOシリーズの性能は細胞内で維持され、極めて高いコントラストで細胞内のCa2+変動を観察することができるようになっただけでなく、複数のコンパートメントでのCa2+の同一細胞内での観察や、Ca2+とATPの同時計測も可能にしました。
なお、この研究は、カナダ・アルバータ大学化学科のロバート・キャンベル准教授,九州大学理学研究院生物科学部門の石原健教授らとの共同で行われました。
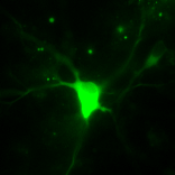
[ 世界最高の検出感度をもつカルシウムイオンセンサー“カメレオン-Nano”の開発 ]
( Kazuki Horikawa, Nature Methods, 7:729-32, 2010 )
Cameleon( カメレオン )は遺伝子工学技術を用いてGFP をもとに開発された蛍光タンパク質であり, 細胞内の信号伝達を担うCa2+をリアルタイムに検出するセンサーとして利用されてきまし た。 これまでにカメレオンをはじめとして,幾つかのCa2+センサーが蛍光タンパク質の改変 や化学合成により開発されてきましたが,従来のCa2+センサーは感度が低いため,自発的な 生命活動に伴う僅かな Ca2+の濃度変化を計測することは難しく、これを可能にする高感度 センサーの開発が求められていました。 研究グループはカメレオンのCa2+結合領域を新奇の方法で改変することにより、Ca2+に対 する結合力を飛躍的に向上させ、超高感度 Ca2+センサー「カメレオン-Nano」の開発に至り ました。 カメレオン-Nano の Ca2+との結合力はこれまでに開発されたCa2+センサーの中で最 も強く、世界最高の感度( 解離定数Kd=15 nM )を有しています。 Ca2+結合領域を微調節することで Ca2+との結合力を変えたセンサーも5 種類開発し、センサーのシリーズ化も実現しま した。 これらの超高感度Ca2+センサーを用いることで,大脳皮質の神経活動を高感度に検出する ことが可能になっただけでなく、生きた動物個体内における神経ネットワークやこれに制 御される筋肉組織の活動パターンの両方を同時計測することに成功するなど、従来の Ca2+ センサーでは検出できなかった現象を捉えることが可能になりました。
[ 群青色蛍光タンパク質 ( シリウス ) の開発 ]
( Wataru Tomosugi, Nature Methods, 6, 351-353, 2009 )
2008年のノーベル化学賞の受賞対象となった緑色蛍光タンパク質 ( GFP, Green Fluorescent Protein ) は、1960年代に下村脩博士によってオワンクラゲから発見され、1990年代にGFP の遺伝子がクローニングされて以来、遺伝子改変により数多くの蛍光色変異体が開発されてきました。とりわけ緑よりも長波長の黄、橙、赤色の蛍光を発する蛍光タンパク質は数多く開発がされてきたものの、短波長の青や紫色の蛍光を発する蛍光タンパク質は未だに種類が少なく、多くの研究者から長年その開発が求められていました。 我々の研究グループは蛍光タンパク質の発色団とそれを取り巻くアミノ酸への変異の導入、さらにはタンパク質全体へのランダムなアミノ酸変異を導入することで紫と青色の中間色である群青色の蛍光を発する蛍光タンパク質Sirius ( シリウス ) の開発に成功し、15年ぶりに蛍光タンパク質の最短波長発光記録が更新されました。これにより蛍光色のバリエーションが増え、従来では不可能であった細胞内の複数の部位やタンパク質を同時にかつ鮮明に可視化することができるようになりました。 Siriusは従来の蛍光タンパク質とは異なり、如何なるpH条件下でも安定した蛍光を発することから、これまで困難であった酸性環境下にある細胞内小器官内でのタンパク質の動態の観察も可能となりました。
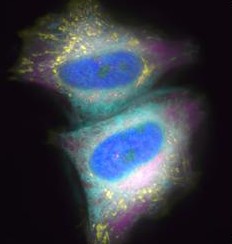
[ 分子デザインにより創生した光変換蛍光タンパク質を用いた、生きた細胞内の生体分子の動きを鮮明に可視化する技術の開発 ]
( Tomoki Matsuda, Nature Methods, 5, 339-345, 2008 )
蛍光タンパク質を用いた生体分子の標識技術は発展を遂げ、今では紫外線などの光刺激によるスイッチングで蛍光色を変化させることのできる光変換蛍光タンパク質が細胞や分子の「動き」を解析するために用いられるようになりました。 従来の光変換蛍光タンパク質では蛍光波長の変化を観察するために、波長の違う2種類の励起光( 蛍光タンパク質を光らせるために与える光 )を用意する必要がありました。 我々は、2つの蛍光タンパク質を繋げたキメラ蛍光タンパク質をデザインしてスイッチング前後の2色の蛍光( 前:シアン色、後:緑色 )を1種類の励起光で観察することのできる光変換蛍光タンパク質 「Phamret( ファムレット )」を開発しました。1種類の励起光で観察できるため、特殊な光学系を使わずに、光変換によって生じた2種類の蛍光を同時に測定することが可能になり、動きの速い分子の映像化を可能にしました。 また、光刺激によるダメージを受けやすい生物には観察のために与える光の量は1種類の励起光だけでよいため負担が少なくなりました。

 NAGAI Laboratory
NAGAI Laboratory