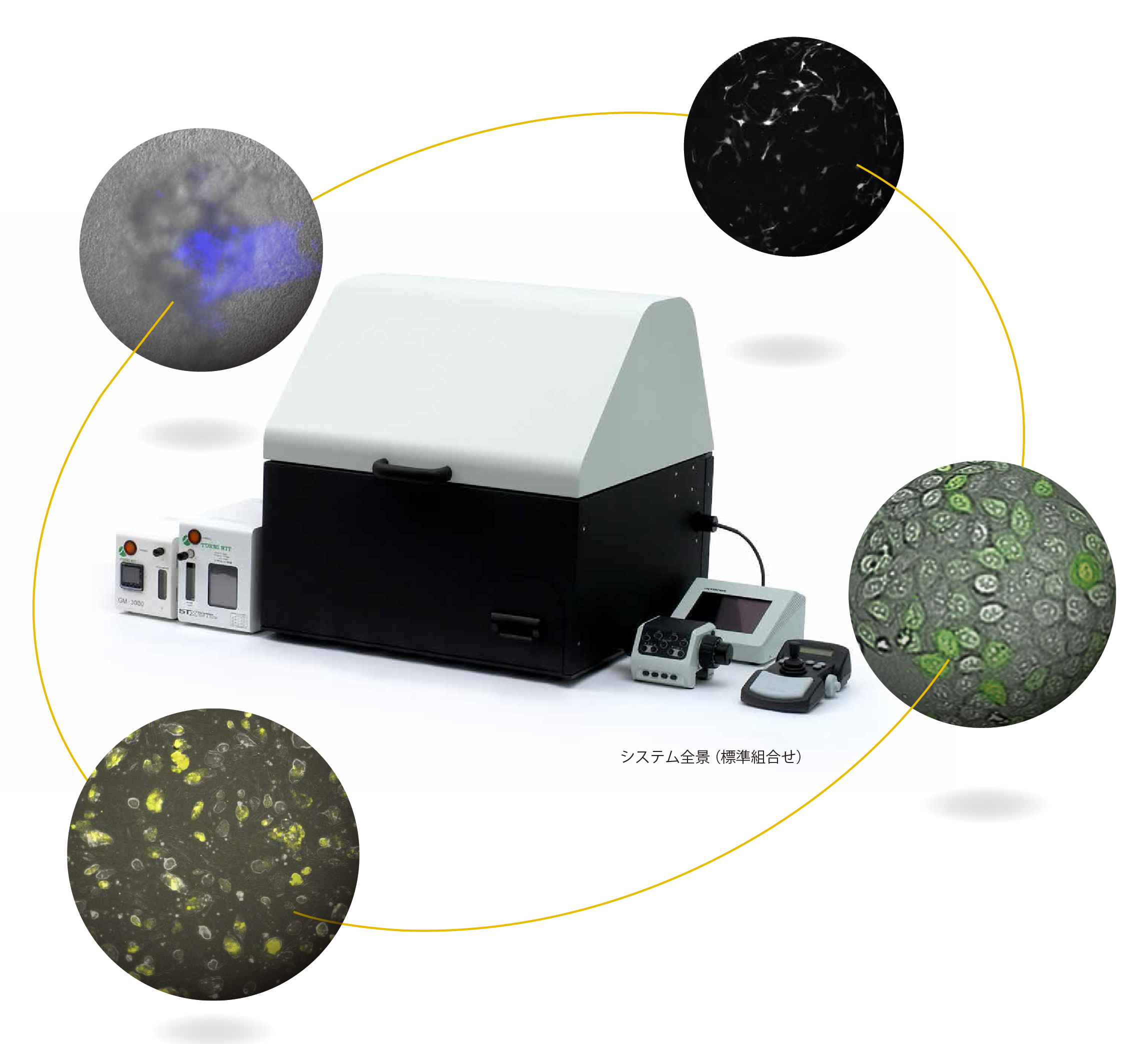
[ 発光が新たなイメージングの可能性を広げます ]
東大小澤研,オリンパス社,東海ヒット社共同研究 ( IXplore Live for Luminescence ), [PDF]
・プレートリーダーやin vivo イメージャーでは難しい1 細胞レベルでの遺伝子発現の観察を実現
・励起光を必要とせず、光毒性のない定量的な解析が可能
・電動ステージにより、マルチウェルプレートでの多検体観察を効率化
・高い遮光性能と培養性能を持ち合わせたボックス型構造により、長時間タイムラプス観察など、安定した実験環境を提供
・蛍光イメージングとの組み合わせで幅広いアプリケーションに対応

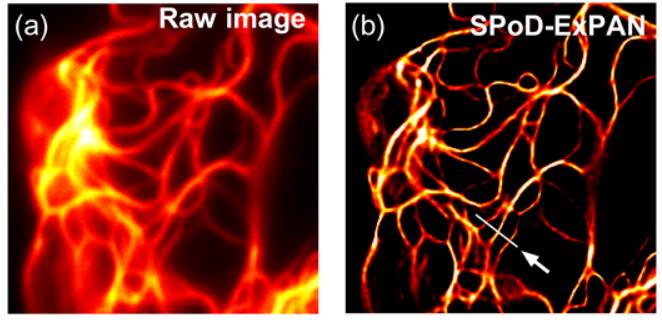
[ 細胞に対する光毒性の少ない超解像イメージング技術の開発 ]
( Tetsuichi Wazawa, Microscopy, 67: 89–98, 2018 )
通常の光学顕微鏡には「回折限界」と呼ばれている空間分解能の理論限界( 約200 nm )がありますが,近年の蛍光顕微鏡の技術革新によって,回折限界を超えた高い分解能の超解像顕微鏡技術が開発されました。これにより,従来の光学顕微鏡では見えなかった細胞中の微細な構造も,そのような新しいタイプの光学顕微鏡によって可視化できるようになりつつあります。しかし,これまでに開発された超解像顕微鏡は試料に対して極めて強い光( 102~109 W/cm2 )で照明することが必要でした。強い光は生体試料に対して毒性があるので,生きたままの細胞や組織をそのような超解像顕微鏡で長時間観察することは困難です。 そこで,我々は,従来よりもはるかに弱い照明光で高解像度観察が可能な超解像顕微鏡の開発を行いました。これは,超解像観察のために我々が開発した光スイッチング蛍光タンパク質であるKohinoor,回転偏光照明を有する超解像蛍光顕微鏡であるSPoD-ExPAN顕微鏡,そして当該顕微鏡のために独自に開発した超解像画像再構成計算手法を組み合わせたものです。これにより,1 W/cm2程度の従来になく弱い照明光で高解像度観察が可能な,生体試料に優しい超解像顕微鏡を実現しました。 これにより,照明光による光毒性がほとんど無いまま,生体試料の詳細を可視化することができます。特に,光からの悪影響が無いまま,細胞の薬剤応答や自律的変化といったプロセスおける細胞内の微細な変化を可視化するのに,この高生体適合性SPoD-ExPAN超解像顕微鏡は有用です。 本研究は,鷲尾研究室( 大阪大学産業科学研究所 )と共同で行いました。

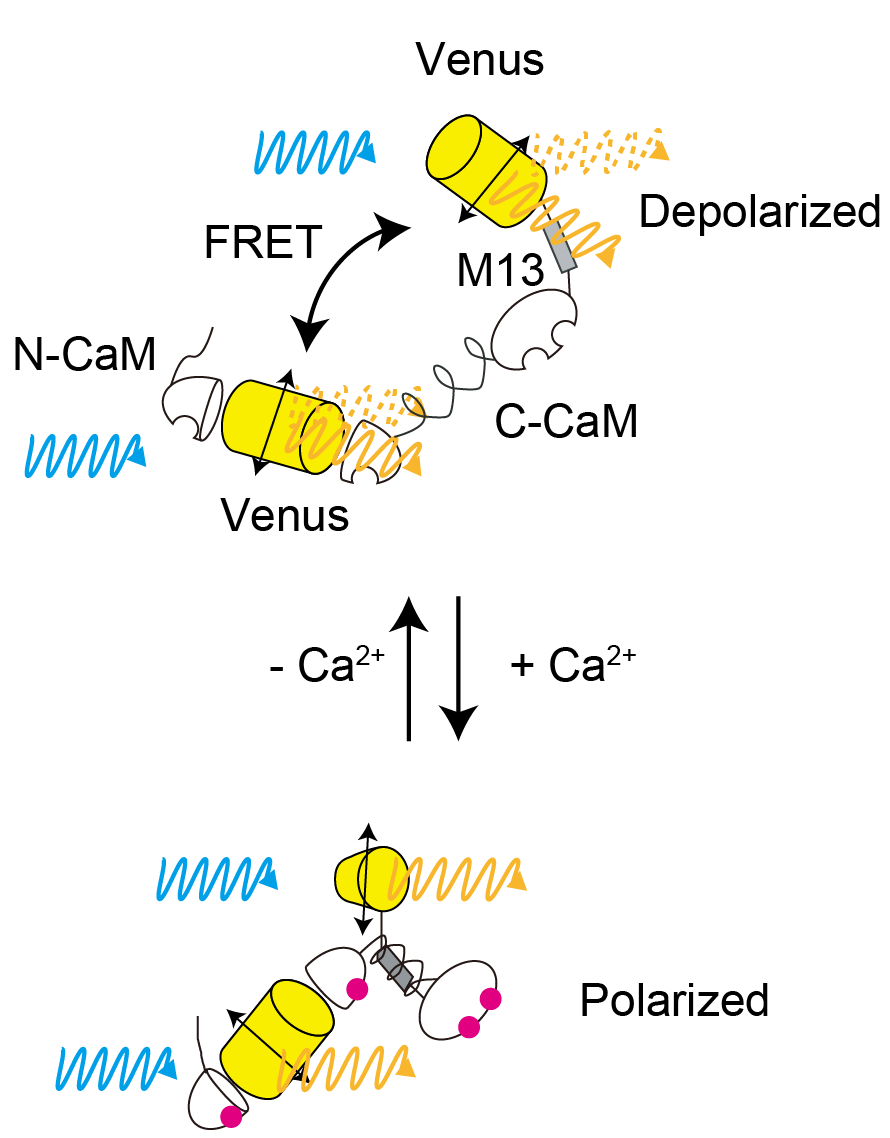
[ フォトニック結晶を用いた高精度偏光顕微鏡によるHomoFRETイメージング ]
( Sang-Yeob Kim, Microscopy, 66: 110–119, 2017 )
蛍光指示薬を用いたバイオイメージングは,細胞内生理活性物質の動態をリアルタイムに計測することが可能です。そのような指示薬は,蛍光強度の変化により活性を計測可能なIntensiometricタイプと, FRETのように二つの異なる指標を用いることによるRatiometricタイプに分類できます。Intensiometricタイプは,計測する波長は1種類であるため,異なる波長域の蛍光プローブを複数同時に計測することが可能である一方, 細胞によって発現量が異なることから定量的な解析が難しくなります。一方,二つの異なる吸収・蛍光スペクトルを有した”ヘテロ”なFRET指示薬では,レシオ値を用いることで,細胞内発現量によらない定量的なイメージングが可能ですが, 広範な波長を計測する必要があるため,複数の細胞内動態を同時に観察することは難しくなります。FRETでは,吸収スペクトルと蛍光スペクトルに重なりがあることが必須なので,ストークスシフトの小さな蛍光プローブを用いれば, 同一の蛍光プローブを用いることができます。さらに,FRETにともなう偏光解消を利用し,プローブの蛍光異方性を求めることで,同一波長を用いながらレシオ計測が可能となります。 しかしながら,一般的な,ダイクロイックミラーを用いた落射蛍光顕微鏡では,ミラー表面にコーティングによる偏光解消や,高開口数対物レンズによる偏光解消効果により, 観察される蛍光異方性のダイナミックレンジが小さくなる問題点があります。そこで本研究ではこれら問題点を解決するために,同一蛍光プローブによる”ホモ”FRET蛍光指示薬の開発及び, フォトニック結晶を利用した高精度蛍光偏光顕微鏡を開発しました。ホモFRET指示薬として,蛍光タンパク質VenusとCa2+結合タンパク質CaMおよびM13を融合した指示薬W-Cameleonを開発しました。 フォトニック結晶では,マイクロファブリケーションにより,基盤の任意の場所で,任意の偏光パターンを実現することが可能です。 そこで,あらかじめ対物レンズによる偏光解消特性を計測し,その偏光解消を補償するようにデザインしたフォトニック結晶を作製しました。 さらに,落射型ではなく透過型照明によりダイクロイックミラーを除外することで,一般的な直線偏光素子を用いる場合にくらべ,高い消光比を有する蛍光偏光顕微鏡の構築に成功しました。本顕微鏡とW-Cameleonを用いることで, 3色の異なる蛍光プローブによる細胞内動態の同時計測に成功しました。
[ MESSIA ]
( Kenta Saito, Cell Struct. Func., 36: 237-246, 2011 )
レーザー走査型共焦点顕微鏡は,細胞内,細胞,組織の3次元観察に使用されています。従来の単一焦点走査型顕微鏡法では,レーザーなどのコヒーレント光源が必要です。 試料面で照明ビームの焦点を結ばせることで,照明スポットのサイズを回折限界近くにまで絞り込みます。これが顕微鏡の空間分解能を決定します。 一方,Nipkowディスクを使用した多点走査型共焦点顕微鏡では,インコヒーレント光源が使用可能です。 以前,コリメートされた照明光をNipkowディスク上のマイクロレンズアレイに入射させる横河の共焦点スキャナーユニットの光源として,超高圧水銀アークランプが利用可能であることを実証しました(Saito et al, Cell Struct. Funct. 33: 133–141, 2008)。 しかし,水銀アークランプからの照明光の主成分である軸外光がNipkowディスクの非開口部分によって遮断されたため,照明光がNipkowディスクを透過する効率が低いという問題がありました。 本研究では,照明光の透過効率を向上させるため,コリメータレンズの光軸上にあるピンホールの周囲に配置したピンホールに軸外光を透過させる光学系を開発しました。 この光学システムは,軸上光だけでなく軸外光も照明光として使用可能とすることで,照明光の光量を大幅に改善しました。本研究で開発した共焦点顕微鏡光学系は,十分なS/Nでの高速共焦点イメージングおよび多色イメージングに応用が期待されます。
[ 吸収増幅顕微鏡CREAM ]
( Yoshiyuki Arai, PLoS ONE, 10: e0125733, 2015 )
光吸収スペクトルは,分子の種類や量を分析できる「分子指紋」として知られています。個々の細胞の状態を調べるためには,それぞれの細胞の吸収スペクトルを測定することが有用です。 しかし,細胞は非常に薄いため,細胞1個の吸収スペクトルを測定することは困難でした。本研究では,1細胞レベルの光吸収スペクトルイメージングのために, 光学キャビティで増強された吸収増幅顕微鏡法(cavity-reflection-enhanced absorption microscopy; CREAM)の開発を行いました。光吸収を光学キャビティによって増幅することにより, 1細胞以下の10 μm程度の光路長しかないサンプルの吸光スペクトル測定が可能になりました。CREAMを用いて様々な哺乳類培養細胞における主成分分析を行ったところ,異なる種類の細胞間のみならず, 同じ種類の細胞の間でも光吸収スペクトル上で多様性があることが明らかになりました。さらに,この顕微鏡技術により,組織サンプルの凍結切片を観察し,無標識で生体組織検査が可能です。 このように,CREAMにより,生体試料の吸収スペクトル画像化を取得することによって細胞1個1個の個性を分析することが可能になりました。

 NAGAI Laboratory
NAGAI Laboratory