研究成果のポイント
・ 生物発光※1の波長 (色) を変化させる手法を新たに開発し、発光色のバリエーションがこれまでで最大の20色に拡大。
・ カラーカメラを顕微鏡に設置することで、従来のモノクロカメラでは検出不可能だった、多数の発光色を示す細胞を同時に撮影することに成功。
・ 細胞集団中のそれぞれの細胞を追跡することが容易になり、細胞運命※2の追跡や、薬剤応答に個性的な反応を示す細胞の探索など、様々な解析への応用が期待される。
概要
大阪大学産業科学研究所の服部満准教授、永井健治教授らの研究グループは、慶應義塾大学の蛭田勇樹准教授とともに、生物発光の波長 (色) を自在に変化させ、個々の細胞を標識することで、複数の細胞を同時に観察する新たな手法を確立しました。
細胞集団において個々の細胞を識別する方法は、細胞運命や薬剤応答など細胞の個性の違いが注目されている現在、その重要性が高まっています。従来の蛍光標識による方法では識別できる数に限りがあり、また対象が増えるほどより複雑な観察システムを必要とします。生物発光の利用は蛍光観察の課題を克服できる可能性があるものの、発光色の種類は十分ではなく、観察方法にも課題がありました。
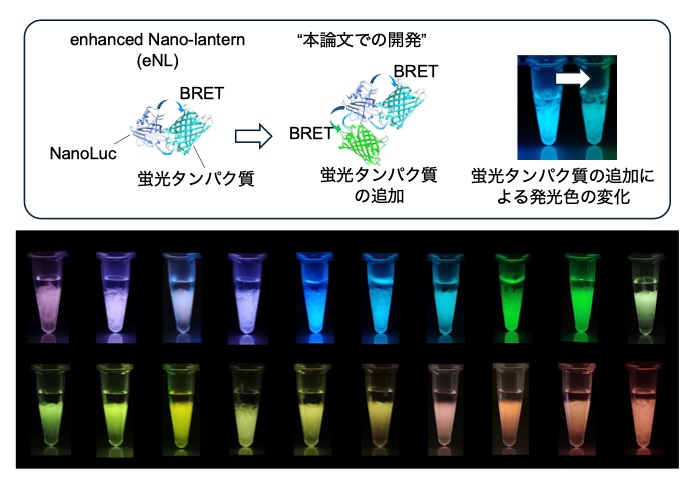
今回、研究グループは、生物発光色を変化させる新たな方法を開発することで、これまででは最大の20色の生物発光タンパク質シリーズ「eNLEX」を開発しました (図1)。
さらにカラーカメラによる撮影方法を導入することで、異なる色で発光する複数の細胞を、生きたまま同時に観察することにも成功しました。
本研究成果は、2025年1月23日(木)午前4時(日本時間)に米国科学振興協会の学術誌『Science Advances』(オンライン)に掲載されました。
研究の背景
無数の細胞で構成される多細胞生物では、同じように見える細胞でもそれぞれに個性があることが知られています。細胞運命の追跡や、他とは特徴量が異なる細胞の同定など、個々の細胞を識別する方法は様々な目的において必要とされます。顕微鏡による観察では、異なる波長をもつ蛍光物質でそれぞれの細胞を標識する方法が一般的に用いられます。蛍光は励起光の波長に応じて発生するため、複数の蛍光種を観察する際には光学フィルターを組み合わせた制御が必要です。ただし、波長が近い場合には正確な分光は困難となるため、画像の撮影後に計算処理を行わない限り、標識できる細胞数には限りがありました。
ホタルの光に代表される生物発光は、生物発光タンパク質が発光基質と反応する際に自発的に生じる光です。蛍光とは違い励起光の照射が不要なため、背景光が少ない、光毒性の懸念が無いなどの利点を有しています。したがって、その発光波長 (色) の種類が十分に準備されれば、細胞標識への利用に大きな可能性を持ちます。しかしながら、生物発光を細胞識別の標識に用いたとしても、従来の分光方法では検出できる色の数に限界がありました。
まとめると、生物発光を用いた細胞識別法の確立には、1. 生物発光の発光色を増やす方法、2. 多数の発光色を同時に検出する方法、の2点が課題となっていました。
研究の内容
研究グループは生物発光の発光色を増やすために、以前開発した生物発光タンパク質enhanced Nano-Lantern (eNL) を基盤にしました。eNLは青色生物発光タンパク質NanoLuc※3に蛍光タンパク質を繋げることで、生物発光エネルギー共鳴移動 (Bioluminescence resonance energy transfer, BRET※4) を引き起こし、その発光色を変化させています。本論文では、eNLにさらに蛍光タンパク質を繋げることで複数のBRETを誘導し、より複雑な発光色を作り出すことに成功しました。最終的に20色にまで発光色のバリエーションを増やし、この生物発光タンパク質シリーズをeNLEX (eNL expansion)と名付けました。
光学フィルターを切り替えてモノクロカメラで検出する従来の方法では、20色のeNLEXの発光色を同時に観察することは不可能です。そこで検出の手段として、スマートフォンなどに装備されているカラーCMOSカメラを用いました。これらのカメラは、検出素子であるCMOSセンサー上にRGB (赤・緑・青) を基本とするフィルターが並んでおり、観察対象から発せられる光を、フィルターを通して検出することで、発光の波長情報を記録することができます。このカラーCMOSカメラを顕微鏡に設置して、細胞観察での実用性を検証しました。eNLEXそれぞれをヒトの培養細胞へ導入して観察した結果、個々の細胞から発せられる20色の発光が同時に観察可能であることが示されました (図2A、B)。eNLEXとカラーCMOSカメラを組み合わせた撮影は、細胞以外にも細胞内小器官※5の識別から、小動物の組織レベルに至るまで、様々なスケールの観察対象に対して実行できます。
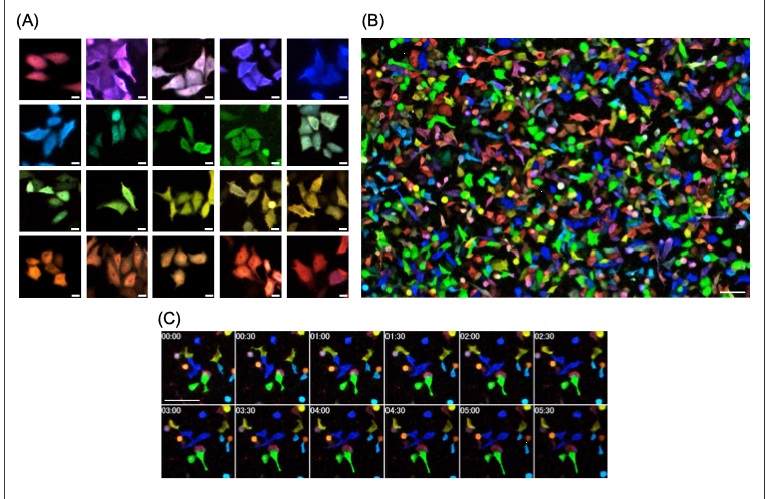
また、撮影した画像からRGB情報を基にそれぞれの発光色を分離することにも成功しました。さらに生きた細胞内での複数の対象について、eNLEXでそれぞれ標識することでその経時的な変化を同時に観察することも可能であり (図2C)、簡便なシステムでタイムラグのない観察を実現しました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果での簡便で低コストな観察システムにより、複数の細胞の同時観察が可能となるため、基礎研究のみならず再生医療研究や創薬分野への導入拡大が期待されます。
特記事項
本研究成果は、2025年1月23日(木)午前4時(日本時間)に米国科学振興協会の学術誌『Science Advances』(オンライン)に掲載されました。
タイトル:“Creating coveted bioluminescence colors for simultaneous multi-color bioimaging”
著者名:Mitsuru Hattori, Tetsuichi Wazawa, Mariko Orioka, Yuki Hiruta, and Takeharu Nagai
DOI:10.1126/sciadv.adp4750
本研究は、文部科学省、日本学術振興会、科学技術振興機構 (JST)、新エネルギー・産業技術総合開発機構 (NEDO) の支援を得て行われました。
用語説明
※1 生物発光
生物発光タンパク質 (ルシフェラーゼ) が触媒となり、発光基質 (ルシフェリン) が酸化される際に生じる発光。ホタルや深海エビなど、様々な発光生物からルシフェラーゼが単離されており、遺伝子発現の標識などに応用されている。
※2 細胞運命
細胞が発生、分化の過程で特定の機能や形態の細胞に決定づけられること。ヒトでは、幹細胞が細胞外のシグナルや遺伝子発現の変化などによって、各臓器などの細胞へと分化する。
※3 NanoLuc
深海エビから単離されたルシフェラーゼOLucに変異を加えて、その発光輝度を向上させたタンパク質。非常に明るいため、市販のカメラだけではなく肉眼でもその発光は確認できる。
※4 BRET
生物発光エネルギー共鳴移動 (Bioluminescence resonance energy transfer) の略。ルシフェラーゼ近傍に蛍光タンパク質が存在する場合に、励起したルシフェリンのエネルギーが蛍光タンパク質へ移動する現象。発光波長が変化するとともに、その発光輝度が増加する場合もある。
※5 細胞内小器官
細胞内で特定の機能を有する構造体の総称。核、ミトコンドリア、小胞体、リソソーム、葉緑体などが含まれる。オルガネラとも呼ばれる。
服部准教授のコメント
普段皆さんが当たり前のように行っているスマートフォンカメラでの撮影と同じ原理で、複数の細胞を観察する手法を開発しました。光源や複雑な装置が不要なこの方法は参入へのハードルが低く、多くの人に使ってもらえる技術となりました。今後は、そのポテンシャルが分かる魅力的な応用例を示していきたいと思います。
参考URL
大阪大学産業科学研究所・永井研究室
https://www.sanken.osaka-u.ac.jp/labs/bse/index.html
慶應義塾大学理工学部・分析化学研究室
https://analchem.applc.keio.ac.jp

