電解反応でつくるリング型分子 ヘテロ[8]サーキュレン
―有機太陽電池や液晶材料など幅広い分野での応用に期待―
研究成果のポイント
-
特殊なリング型分子であるヘテロ[8]サーキュレンについて、電解合成による骨格構築に成功し、合成した本サーキュレンが、有機光触媒※1として機能することを発見
-
過酷な条件や高価な試薬を要するなど研究が停滞する分野であったが、市販試薬を用いてわずか2工程での安全・低コストな合成を可能に
-
その機能・特徴も容易に修飾・調整できることから、有機太陽電池・液晶材料など、幅広い分野での応用に期待
概要
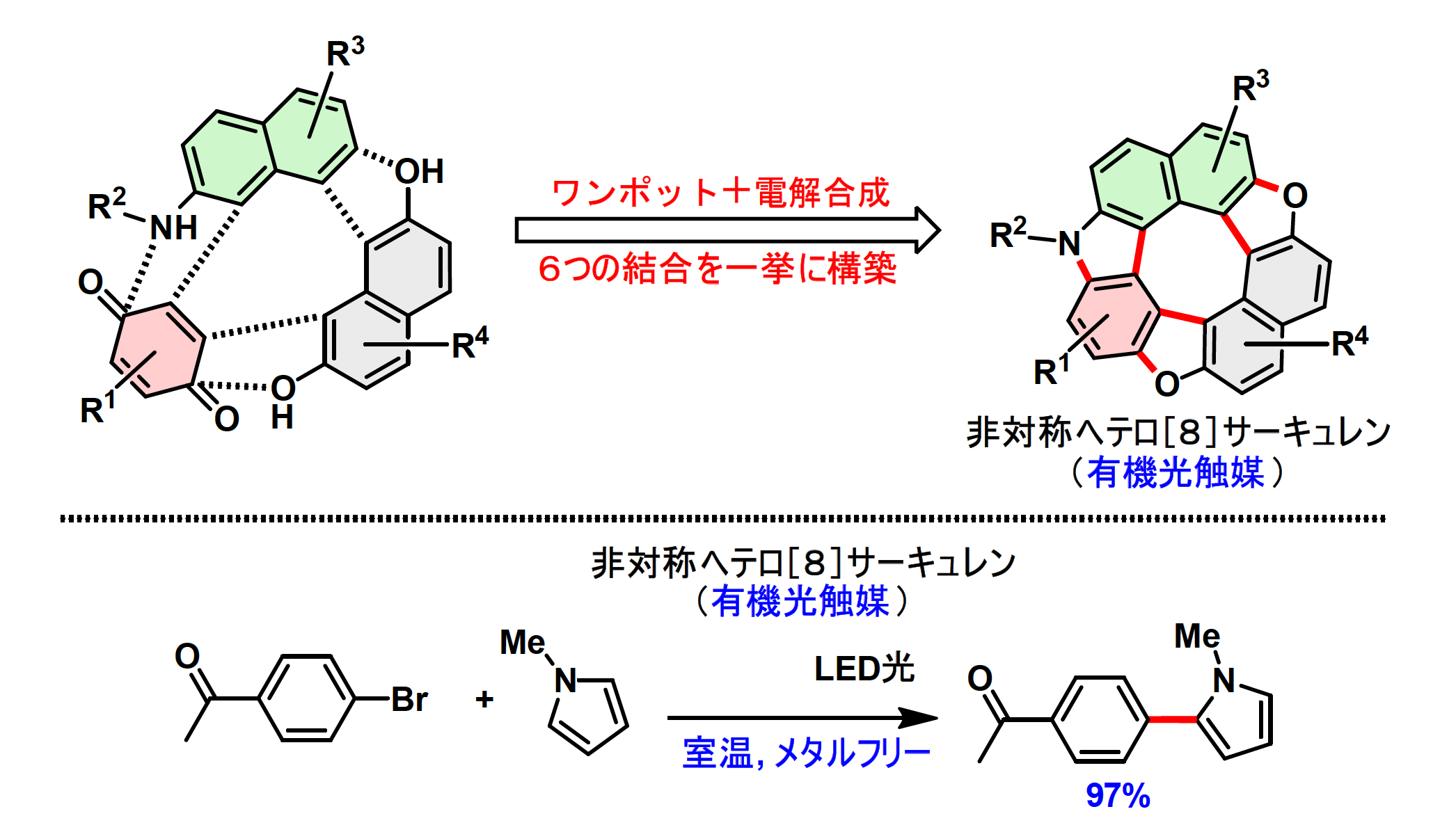
大阪大学産業科学研究所のMohamed S. H. Salem特任助教(常勤)、滝澤忍教授、同大学大学院工学研究科の安田誠教授らの共同研究グループは、入手容易な市販原料であるアニリン、キノン、ナフトール類を用いて電解合成を行うことで、世界で初めて簡便・安全・低コストな非対称ヘテロ[8]サーキュレン骨格の構築に成功しました。また、新規ヘテロ[8]サーキュレンの分子構造・電子の動き・光や電気への反応性を解析した結果から、本サーキュレンが有機光触媒として機能することを明らかにしました(図1)。この電解合成の副生物は水のみであり、環境にも低負荷なπ共役分子※2の合成方法として、有機太陽電池、液晶材料など幅広い分野での応用が期待されます。
本研究成果は、Springer Nature社 『Nature Communications』 に、7月1日(火)に公開されました。
触媒などの有用な機能性物質を作り出す新しい有機合成反応の開発は、SDGsの観点からも大変重要な研究テーマです。そして、副生する廃棄物にも配慮した、真に環境に低負荷な反応プロセスの開発も益々重要となります。有用物質をグリーンに合成し、様々な分野に波及効果のある研究を今後も日本から発信していきます。
研究の背景
[8]サーキュレンは、8つのベンゼン環が輪のようにつながった構造を有する分子で、広いπ共役系を持ちます。中でもヘテロ[8]サーキュレンは、窒素(N)や酸素(O)、硫黄(S)などといったヘテロ原子の種類や数、導入する位置を変えることでπ共役骨格の電子的・光学的・化学的性質を自在に調整でき、有機EL、有機トランジスタ、有機太陽電池、液晶材料、エネルギー関連材料など幅広い分野での応用が期待されています。多様なヘテロ[8]サーキュレンがデザイン可能なものの、実際はタイプI, II, III(図2)の合成が報告されているのみです。
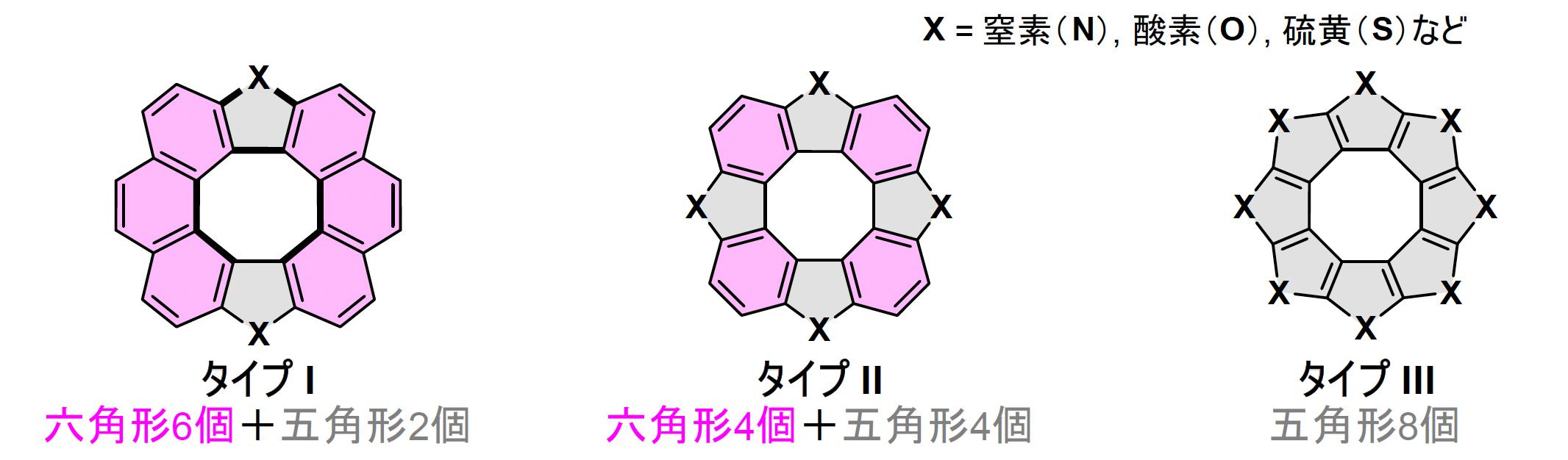
これはヘテロ[8]サーキュレン合成法が、多段階反応による低収率、高温などの過酷な条件、高価な金属試薬や大量の酸化剤の使用を必要とし、官能基及び位置選択性の問題を避けるために対称な構造を有する原料を用いることが一因でした。そのため既存骨格の修飾による機能調整が研究の主流となり、新しい骨格や非対称構造の探索はほとんど研究されてきませんでした。
研究の内容
今回研究グループは、環境調和性と高い化学選択性が期待できる有機電解合成に着目しました。これまでに当研究室が開発してきたヘテロ環を含むヘリセン※3やその誘導体の電解合成法を応用し、5つの6員環と3つの5員環からなる新しいタイプ(Type Ⅳ)の非対称型ヘテロ[8]サーキュレンの合成手法を設計しました。この方法は市販原料からワンポットで6本の新しい結合を形成でき、効率的かつ簡便です(図3)。
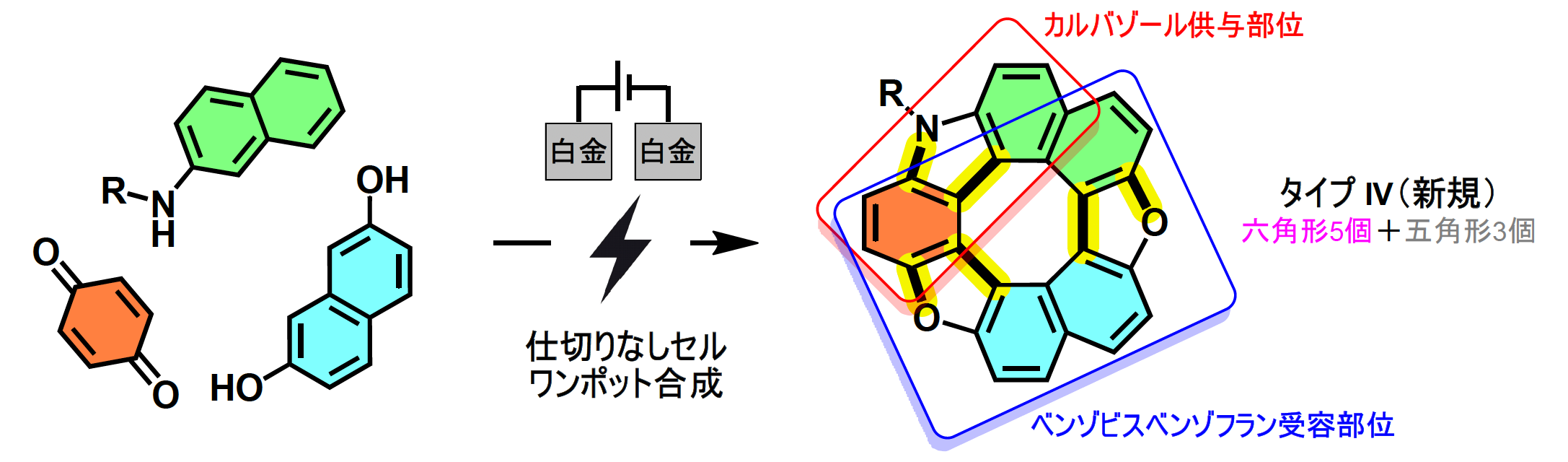
得られた非対称型ヘテロ[8]サーキュレンについては、X線結晶構造解析・吸収スペクトル測定・密度汎関数理論計算※4などにより構造・光学・電子特性を詳細に評価しました。特に、この分子は低還元電位のカルバゾール供与部位と電荷輸送・電子注入性を持つベンゾビスベンゾフラン受容部位を兼ね備えており、有機光触媒としての機能が期待されました。実際、非対称型ヘテロ[8]サーキュレンにLED光を照射すると有機光触媒として機能し、遷移金属(パラジウムなど)フリーな条件下にて、クロスカップリング反応※5を最大97%の高収率にて促進することを見出しました(図1下)。
本研究成果が社会に与える影響(本研究成果の意義)
今回開発した電気化学合成プロセスは環境に与える負荷が極めて小さく、実際、酸化・還元試薬を必要とせず、副生成物は水のみです。より環境にやさしく効率的な化学変換法の実現を期待させます。私たちの電気化学プラットフォームは、計算化学や機械学習と組み合わせることで、光電子デバイスや有機合成の新しい材料開発研究を加速します。
特記事項
本研究成果は、2025年7月1日(火)にSpringer Nature社が刊行するオープンアクセスジャーナル 『Nature Communications』 に掲載されました。
タイトル:“Electrochemical cascade access to hetero[8]circulenes as potent organophotocatalysts for diverse C–X bond formations”
著者名:Ahmed S. Gabr, Mohamed S. H. Salem, Md. Imrul Khalid, Ryota Takahashi, Yoshihiro Nishimoto, Makoto Yasuda, Shinobu Takizawa
DOI:10.1038/s41467-025-60889-w
なお、本研究は、JST 戦略的創造研究推進事業「革新反応研究」、及び文部科学省科学研究費助成事業「学術変革研究A:デジタル化による高度精密有機合成の新展開」の一環として行われました。
用語解説
※1 有機光触媒
金属を使わず有機分子が光を吸収して化学反応を促進する触媒。環境負荷が低く再利用可能な特
徴を有する。
※2 π共役分子
分子内で、二重結合(=)と単結合(−)が交互に並んでいる構造をもつ分子のこと。電子(π電子)が
分子内を自由に動きやすくなるという特徴を有する。
※3 ヘリセン
複数の芳香環がらせん状につながった剛直なπ共役分子。分子がねじれた立体構造を持ち、光学活性や特異な電子・光学特性を示す。
※4 密度汎関数理論計算
電子の分布(電子密度)を基に物質の構造やエネルギーを効率的に予測する量子化学計算法。
※5 クロスカップリング反応
有機分子同士を触媒(主にパラジウム)で結び付け、新しい結合をつくる手法。医薬品や電子材料などの合成に不可欠であり、2010年に鈴木章・根岸英一・R.ヘックがノーベル化学賞を本反応開発研究で受賞。





