発表のポイント
・高感度で高精度な蛍光タンパク質温度センサーELP-TEMPを開発。
・従来の蛍光タンパク質温度センサーは、感度が低いという課題があったが、ELP-TEMPは従来の10倍以上の感度と精度を達成。
・生体内や細胞内における未知の熱産生現象を発見する基盤技術となり、医学・創薬研究への貢献が期待される。
概要
大阪大学産業科学研究所の永井健治教授らの研究グループは、 33~40℃の範囲における温度変化に対して蛍光※1が高い精度で高感度に応答する蛍光タンパク質※2温度センサー"ELP-TEMP"の開発に成功しました。ELP-TEMPを導入した細胞を蛍光顕微鏡※3で観察することで、1細胞内の温度分布をミクロン以下の空間分解能で測定することが可能です。
高感度な蛍光タンパク質温度センサーを開発するにあたり、温度応答性のエラスチン様ポリペプチド (Elastin-like polypeptide;ELP) ※4とフェルスター共鳴エネルギー移動(FRET)※5のペアとして使用可能な蛍光タンパク質mTurquoise2およびmVenusを構成要素に用い、ELPの一端にmTurquoise2、他端にmVenusを接続した分子デザインを着想しました(図1)。ELPは、下限臨界溶液温度※6と呼ばれる特性温度を超えると、急峻に大きな構造変化を起こすと ともにELP分子同士が会合します。このようなELPの変化により、mTurquoise2とmVenus間の平均距離が著しく減少し、FRET効率が増加することで、mVenus/mTurquoise2の蛍光強度比が増加します(図1)。哺乳類細胞の温度測定のために、このようなデザインの蛍光タンパク質温度センサーの作成を試行錯誤することでELP部分の最適化を行い、33~40℃における高感度温度測定に適したELP-TEMPの開発に成功しました。

図1:ELP-TEMPの分子デザインと温度応答の原理の模式図
蛍光タンパク質温度センサーは、その遺伝子を細胞内に導入して細胞に作らせることで、特定のタンパク質複合体や細胞小器官の標識が可能なため、細胞内温度変化や温度分布の計測に非常に有用です。しかし、従来の蛍光タンパク質温度センサーは、温度変化に伴う蛍光シグナル変化(温度感度)が約3%/℃程度であり、感度が十分高いとは言えませんでした。これらとは対照的に、ELP-TEMPは、33~40℃の温度範囲で最大45%/℃という非常に高い温度感度で顕微鏡観察が可能になりました(図2)。また、蛍光タンパク質以外に、蛍光色素、希土類錯体、量子ドット、そして蛍光色素とポリマーの複合体などを用いたナノメーター程度の温度センサーも開発されていますが、これらの温度感度と比べてもELP-TEMPの温度感度は高いです。細胞中の温度測定の例として、ELP-TEMPを用いることで、化学的に刺激を与えた細胞中で発生した1.5℃の温度上昇が検出可能なことを確認しました(図3)。ELP-TEMPは、生体内や細胞内における未知の熱産生現象を発見するための基盤技術として、医学・創薬研究にも大きく貢献すると期待されます。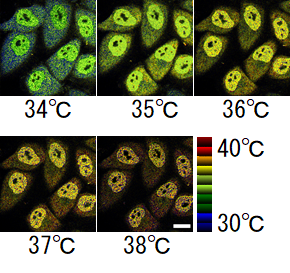
図2:ELP-TEMPのHeLa細胞中での温度応答。スケールバーは、20μm。
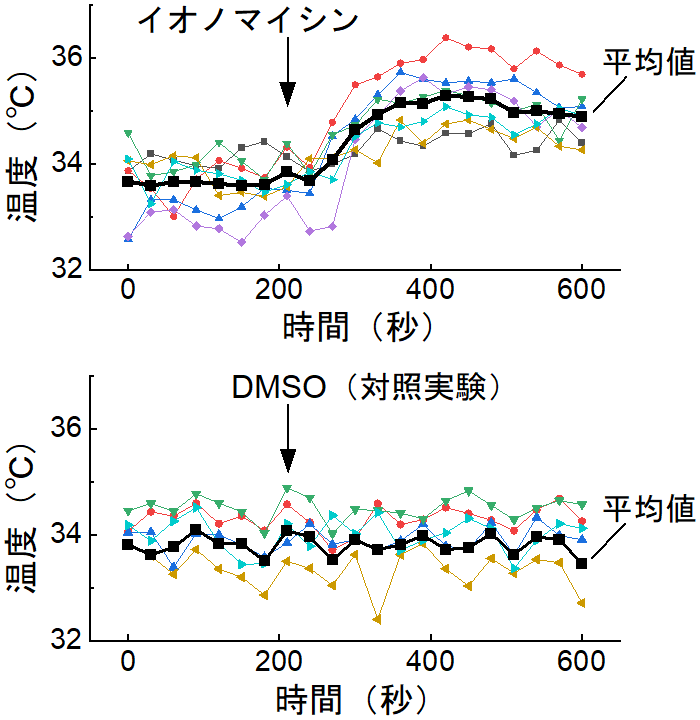
図3:化学刺激によるHeLa細胞中の温度上昇の測定。
本研究成果は、2021年8月13日(金)に英国科学誌「Scientific Reports」(オンライン)に掲載されました。
研究の背景
生体内で起こる代謝、酵素反応、運動、情報伝達等の多くのプロセスは、温度に影響されます。恒温動物である哺乳類では、体内における熱産生によって体温の恒常性が維持されており、脳や内臓、褐色脂肪組織、そして筋肉が主な熱源と考えられています。体内における熱産生のうち、筋肉で起こる「ふるえ熱産生」の仕組みは比較的良く分かっていますが、筋肉以外で起こる「非ふるえ熱産生」の仕組みは解明が進んでいません。特に、「非ふるえ熱産生」は、生活習慣病との関連性も注目されており、近年研究が盛んに行われています。さらに、1個1個の細胞の中で、どの細胞小器官でどの程度の温度変化が発生するかを高感度で測定 することは、これまで困難でした。
蛍光顕微鏡は光学顕微鏡の一種であり、蛍光タンパク質や蛍光色素で標識した細胞や組織を生きたまま観察できる研究手段です。蛍光標識した生体試料に対して励起光と呼ばれるある特定の色の光を照射すると、試料から励起光とは異なる色の蛍光が発生するので、これを顕微鏡で観察します。温度測定に用いられる蛍光タンパク質温度センサーや蛍光色素温度センサーの大きさはナノメーター程度と小さく、熱容量※7も極めて小さいため、細胞のような非常に小さい測定対象でも、センサーが細胞の温度に影響することなく温度測定が可能です。特に、蛍光タンパク質温度センサーは、その遺伝子として細胞内に導入して細胞に作らせることで、特定のタンパク質複合体や細胞小器官の標識が可能なので、細胞内温度の非侵襲計測に非常に有用です。しかし、従来の蛍光タンパク質温度センサーは細胞内の小さい温度上昇を捉える のに十分な感度がなかったため、高感度な蛍光タンパク質温度センサーの開発が強く期待されていました。
本研究成果が社会に与える影響(本研究成果の意義)
本研究成果を応用することで、細胞小器官での熱産生や細胞内の温度分布を高感度でライブ観察できるようになります。こうした新規ツール開発を通じて、細胞内で起こる未知の熱産生プロセスの解明や、細胞内熱産生が関わる疾病メカニズムの詳細解明が期待されます。
特記事項
本研究成果は2021年8月13日(金)に英国科学誌「Scientific Reports」(オンライン)に掲載されました。
タイトル:"A highly-sensitive genetically encoded temperature indicator exploiting a temperature-responsive elastin-like polypeptide"
著者名:Cong Quang Vu, Shun-ichi Fukushima, Tetsuichi Wazawa, and Takeharu Nagai
DOI: https://doi.org/10.1038/s41598-021-96049-5
なお、本研究は、JST戦略的創造研究推進事業CREST「次世代フォトニクス」領域における研究課題「超解像「生理機能」イメージング法の開発と細胞状態解析への応用」(研究代表者:永井健治)の一環として行われました。
用語説明
※1 蛍光
光を吸収し、その光よりも低エネルギー(長波長)の光を放出する物質の性質のこと。mTurquoise2は紫色光(430 nm)を吸収し、青色光(480 nm)を放出する。mVenusは青緑色光(515 nm)を吸収し、緑色光(530 nm)を放出する。
※2 蛍光タンパク質
蛍光を発するタンパク質の総称。2008年のノーベル化学賞で知られる下村修博士らが、1962年にオワンクラゲから初めて遺伝子を単離し、緑色蛍光タンパク質(Green Fluorescent Protein, GFP)と命名した。
※3 蛍光顕微鏡
試料の蛍光を観察する光学顕微鏡。光学顕微鏡に、励起光の光源、そして結像光学系に励起光をブロックするための光学フィルタが用いられる。
※4 エラスチン様ポリペプチド(Elastin-like polypeptide;ELP)
皮膚や血管等の弾性組織のエラスチンタンパク質に含まれる特徴的なアミノ酸配列を有する人工ポリペプチド。
※5 フェルスター共鳴エネルギー移動(FRET)
2個の蛍光色素分子がナノメーターオーダーの距離まで近接した時、一方の励起状態の蛍光色素(供与体)の励起エネルギーが他方の蛍光色素(受容体)に移動する ことで、受容体からの蛍光発光が観測される現象。
※6 下限臨界溶液温度
ある特定の温度以上で溶液が2つの相に分離する時、この温度を下限臨界溶液温度という。
※7 熱容量
ある物体に熱を供給してその温度を1℃上昇させるのに必要な熱量。
コメント
蛍光タンパク質温度センサーELP-TEMPの開発にあたり、センサーの温度感度を向上させると、温度変化以外の外乱にも応答して蛍光シグナルが変化することが問題となりました。これは、ELP-TEMPの蛍光シグナルと温度を精密に対応付けするための校正データを測定して用いることで計測手法的に解決し、例えば細胞内の核と細胞質の温度の厳密な比較が可能になりました。


